干货分享 | 小动物脉搏血氧仪助力肺损伤动物无创精准血氧检测!(内附详细实验方法)
血氧饱和度(SpO2)是血液中被氧结合的氧合血红蛋白的容量占全部可结合的血红蛋白容量的百分比,是呼吸、循环系统的重要参数,在临床疾病的预防、诊断、监护中发挥着重要作用,也作为重要生理指标广泛应用于动物手术监护与呼吸循环系统相关研究中。

传统血氧饱和度测量采用有创方式,抽取动脉血,通过血气分析仪进行电化学分析,测出氧分压进行计算获得血氧饱和度。该方法是测量血氧饱和度的金标准。但对于小动物而言,血液总量较少,获取动脉血的难度较高,而且无法进行持续测量。
MouseOx Plus脉搏血氧仪专为大小鼠SpO2检测设计,仅通过单个探头即可测量大小鼠的血氧饱和度、脉搏频率、呼吸频率等生理参数,实现大小鼠SpO2的无创、连续、准确监测。
文献案例
01.基质细胞蛋白SPARCL1在流感病毒诱发的肺损伤中的作用

在实验过程中,使用MouseOx Plus颈夹对头颈部已进行脱毛处理的小鼠以15Hz的采样频率连续测量3min,并导出测量结果、过滤错误值,最后以均值作为该时间点的血氧饱和度结果。
通过比较流感感染24天内野生型小鼠与Sparcl1基因敲除小鼠、野生型小鼠与Sparcl1基因过表达小鼠、Sparcl1基因过表达小鼠与TLR4抑制剂给药的过表达小鼠的血氧饱和度以及其他生化、免疫分析,证明了SPARCL1通过激动TLR4与促进巨噬细胞的极化加剧肺炎。
该研究揭示了肺部毛细血管内皮细胞与巨噬细胞进行信息交流并活化巨噬细胞的新机制,证明了SPARCL1水平可用作为肺炎的生物标记物,PARCL1/TLR4/NF-κB拮抗剂可作为潜在的减轻炎症的药物。
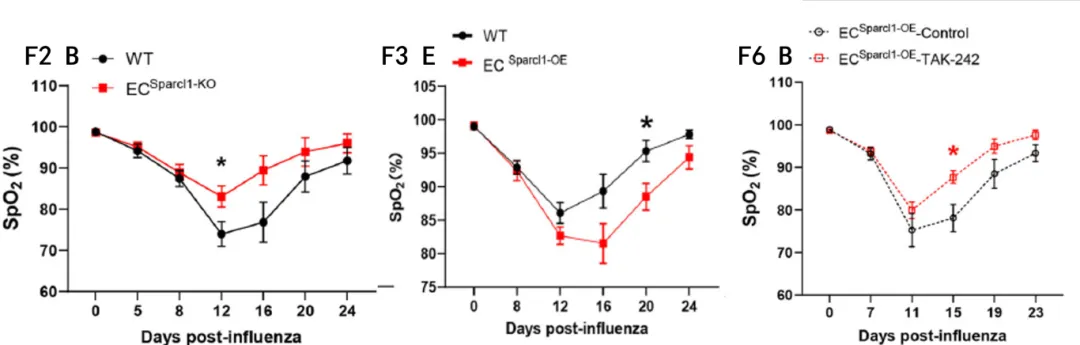
图F3 E:Sparcl1基因过表达小鼠血氧浓度较低,表明了Sparcl1基因过表达加剧了肺部炎症;
图F6 B:腹腔注射TAK-242(TLR4抑制剂)的Sparcl1基因过表达小鼠血氧浓度较高,表明TLR4参与了加剧炎症的过程。
参考文献:
Zhao, Gan et al. “Vascular endothelial-derived SPARCL1 exacerbates viral pneumonia through pro-inflammatory macrophage activation.” Nature communications vol. 15,1 4235. 18 May. 2024, doi:10.1038/s41467-024-48589-3 血管内皮来源的 SPARCL1 通过促炎巨噬细胞活化加剧病毒性肺炎IF 14.7
02.mRNA的器官特异性高效递送过程中的血氧监测

在验证肺部给药的过程中,研究团队使用流感病毒建立小鼠肺血管损伤模型,使用Si5-N14 LNP递送成纤维细胞生长因子-2(FGF-2)的mRNA ,并通过MouseOx Plus监测小鼠血氧。
通过比较血氧、体重、组织形态等方法验证了通过SiLNP进行FGF-2 mRNA给药能够增强肺部血管修复,展示了基于该递送系统的靶向血管内皮治疗疾病的潜在临床应用潜力。
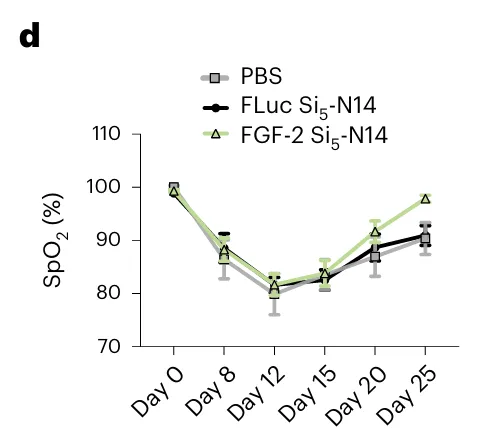
图F6 D:通过SiLNP进行FGF-2给药的小鼠血氧饱和度恢复情况更好,表明SiLNP递送的FGF-2 mRNA能够增强肺部血管修复。
参考文献:
产品介绍
01.产品简介
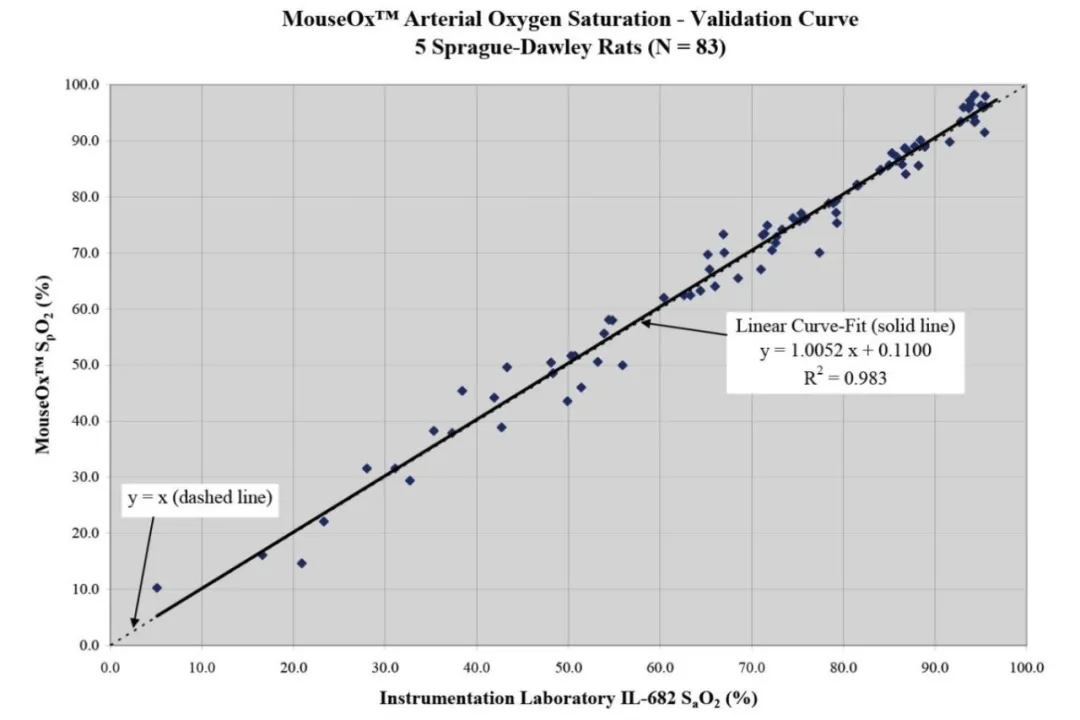
下图是使用有创血气采样测量结果与无创MouseOx测量结果的比较,对比表明,两者具有很好的线性关系;

产品特点
01.产品简介
1.媲美血气分析仪的高准确性
下图是使用有创血气采样测量结果与无创MouseOx测量结果的比较,对比表明,两者具有很好的线性关系;
2.支持麻醉测量和清醒测量
专有波形优化算法,针对麻醉和清醒状态的动物独立优化,无论是清醒状态还是麻醉状态,特殊的传感器和软件模块都可持续监测动物生理信号;
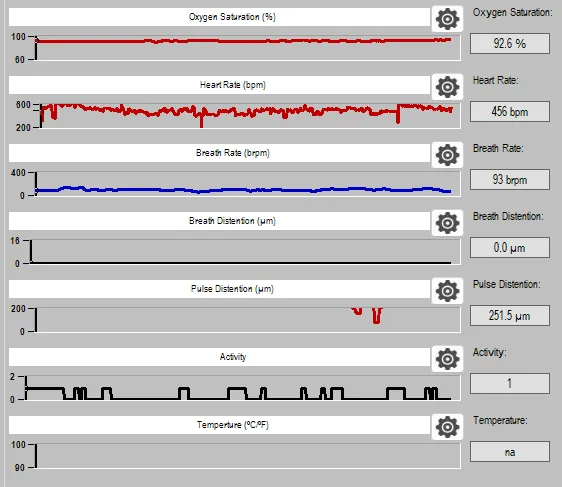
3.无创测量最多7个参数
通过1个脉搏血氧探头即可测量多达6个生理参数包括:血氧饱和度、脉搏频率、呼吸频率、脉搏幅度、呼吸幅度、活动度等。通过1个额外的温度探头还可测量肛温。无需侵入性手术操作,减少实验工作量,同时减少对动物的伤害;
4.传感器规格丰富,满足不同实验需求
可搭配多种不同类型,不同尺寸的传感器,满足不同体型的大鼠、小鼠、新生大鼠的不同部位的监测需求。还具有核磁兼容型传感器,可用于核磁共振环境。

应用领域
01.转化医学研究
急性呼吸道疾病、缺血、休克动物模型、中风和脑损伤研究、心血管疾病、缺氧和吸入染毒研究等;
02.动物生理监护
仪器自带报警功能,可用于手术中确保适当的麻醉深度、预防缺氧、防止术中低体温、辅助氧气量调整。
实验方法
01实验准备
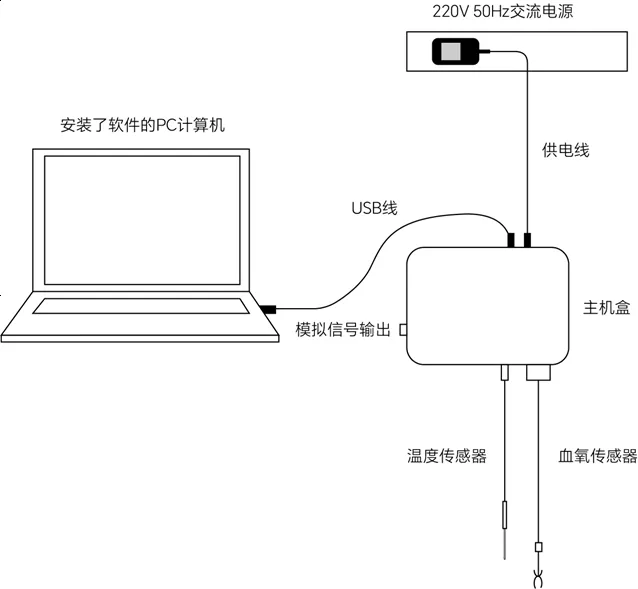
打开设备储存箱,将主机与电源、传感器以及电脑连接,如图所示;若测试清醒状态还需提前安装好活动笼,麻醉状态则需准备好保温板维持体温;
2.环境准备
选择合适的实验地点,确保环境温暖,无荧光灯等会造成荧光干扰的设备;
3.动物准备
准备待测量的实验动物,若动物毛色较深,需做剃毛或脱毛处理;
4.前期适应
提前15分钟使用适应夹子夹住实验动物,让其提前适应,防止不适应产生血氧较低的情况;
5.连接动物
根据实验动物的种类、体型、测量部位选择合适的夹具,将夹具与实验动物夹紧。
02参数设置
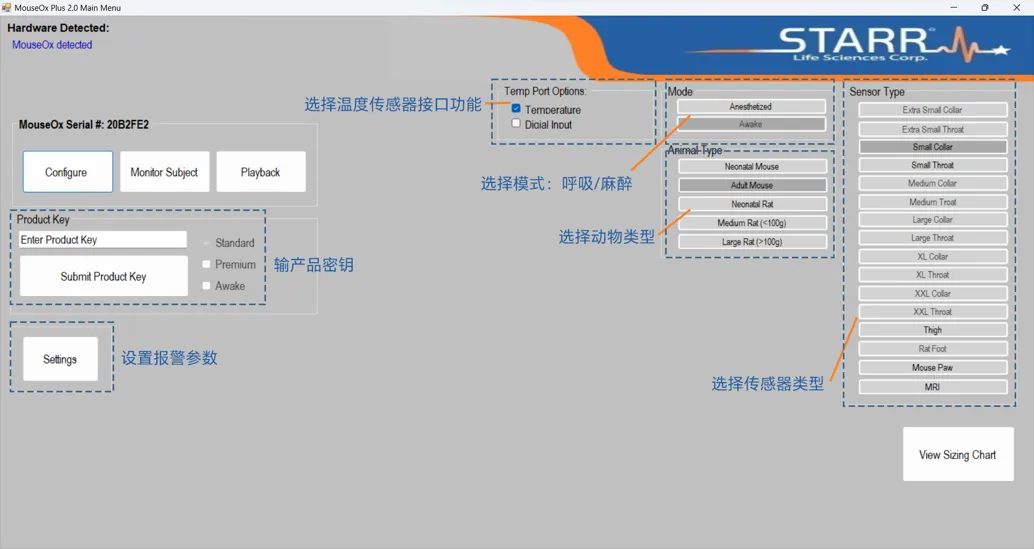
1.软件激活
打开已安装好的软件,在软件参数配置输入主机盒上的软件激活密钥,点击提交即可激活数据记录功能;
2.参数设置
根据实验需求设置检测模式、动物类型、传感器类型监测功能,软件将会根据设定的参数优化数据采集过程,提高数据精准度。
03开始监测
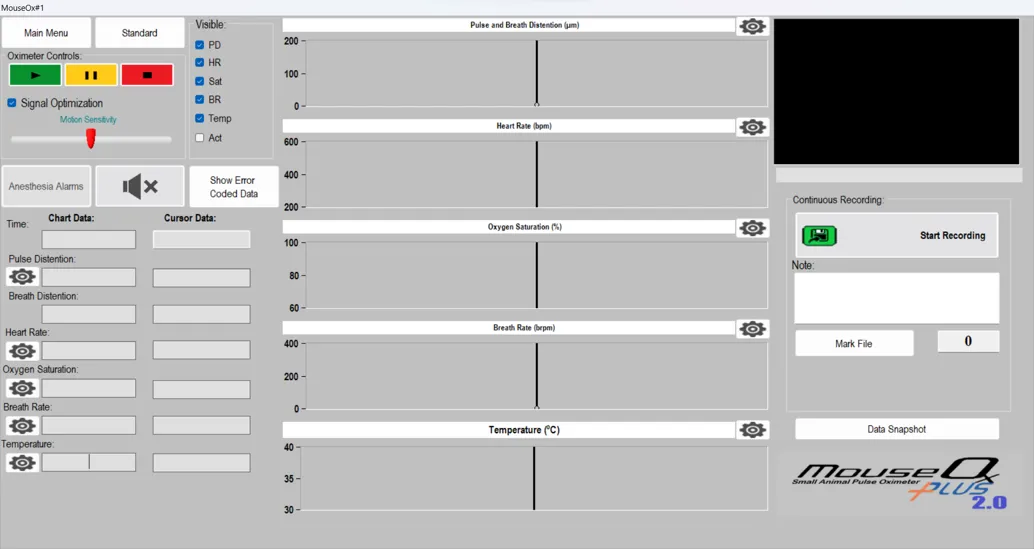
1.开启监测
单击绿色按钮开始进行监测,此时传感器的灯光应该亮起,监测界面右上角会出现波动的红色与黄色波形,表明开始采集生理信号;
2.暂停监测
在实验过程中随时可以单击黄色按钮暂停监测,单击绿色按钮即恢复监测,方便中途对动物进行处理;3.终止监测
完成实验后点击红色按钮则会终止监测。
04数据采集
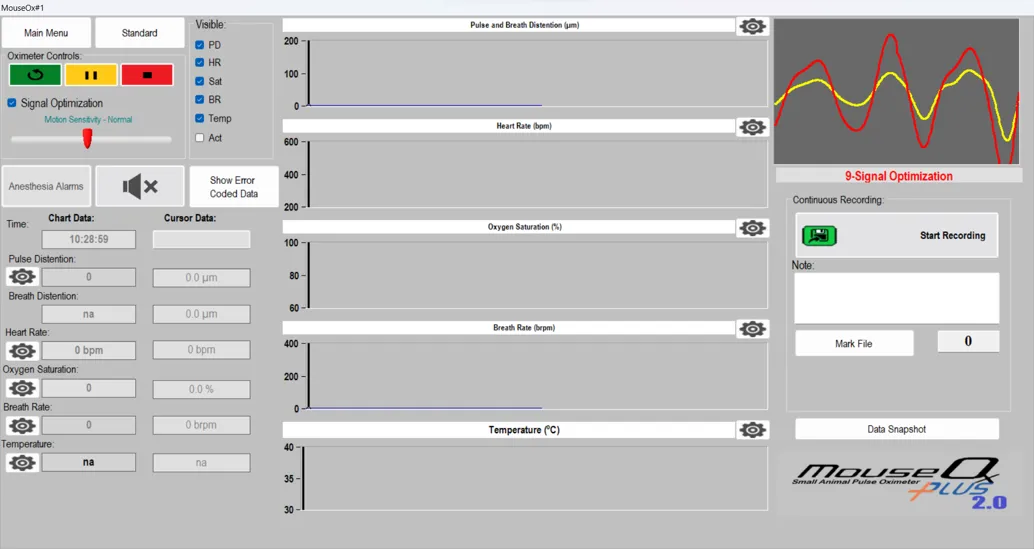
1.判断监测状态
右上角红色、黄色波形相近、下方无红色提示时,表明监测状态稳定,建议此时进行监测;
2.开始采集
单击波形图下方的绿色标签“Start Recording”开始进行数据采集,数据将开始保存在计算机中;
3.结束采集
单击波形图下方的红色标签“Stop Recording”,单击左上角红色停止按钮停止整个监测过程,数据将会保存在您预设的文件夹内;
4.打标与记录
在记录过程中您随时可以通过Note和Mark File按钮进行记录与打标,导出数据后这些信息将一并呈现,方便后期的数据处理
05.数据回演
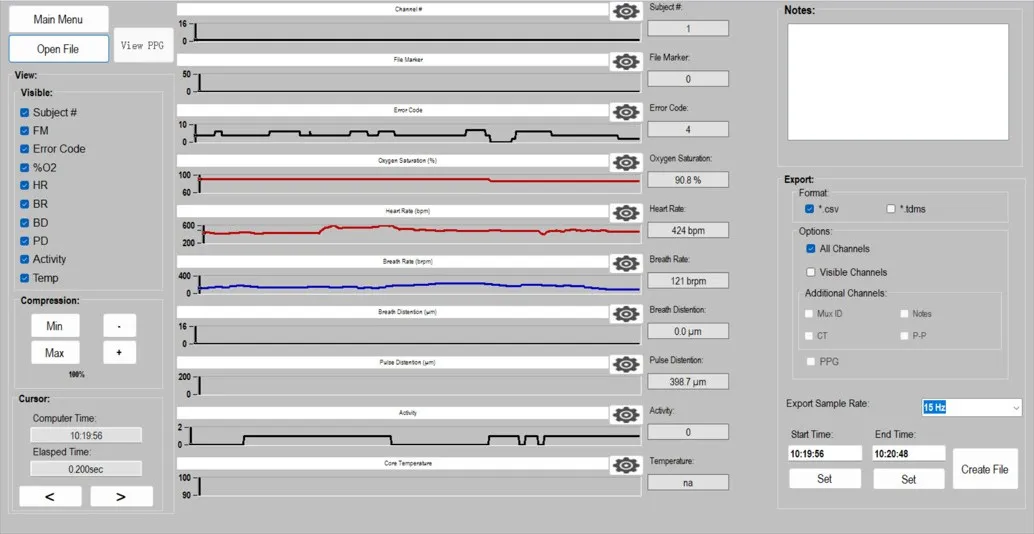
1.打开数据文件
返回软件主界面,单击“Playback”打开数据回演。单击左上角“Open File”按钮,选择MouseOx数据文件;
2.查看数据
软件将呈现整个记录数据内各个生理参数的波形图,拖动波形框上的垂直线查看当前轴的数据,如果数据文件中存在保存了PPG波形,可单击View PPG可查看血容积图。
06.导出数据为表格
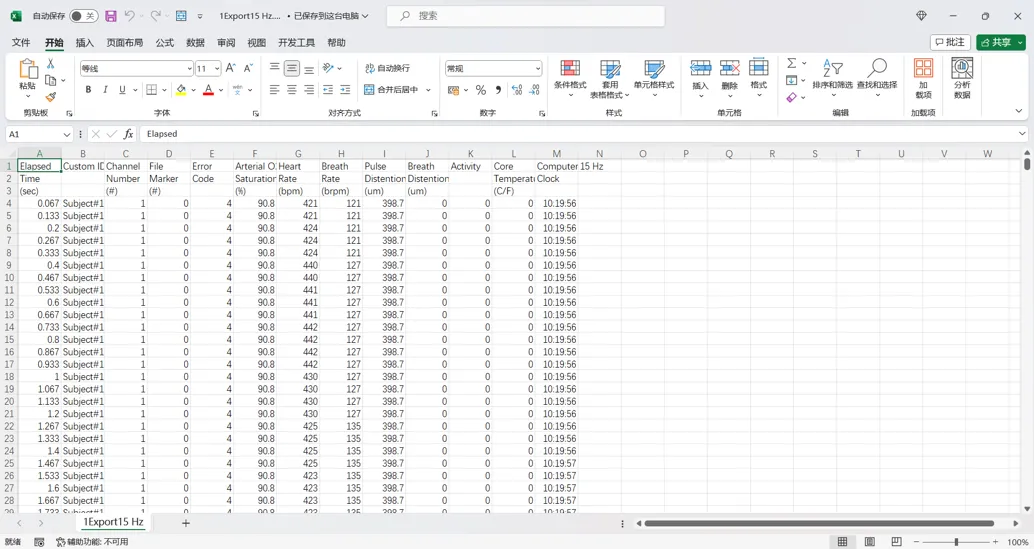
1.数据导出
单击右下角Creat File,可将当前数据导出为“.csv”格式;
2.数据说明
打开表格,从左到右分别为仪器的运行时间,实验组别,通道数,状态代码,脉搏血氧值,心率,呼吸频率,脉搏幅度,呼吸幅度,活动度,体温和监测时间。1秒内可存在15个数据点,满足后期分析需要。
07.实验结束
实验结束时,请先将软件停止记录和采集,再拔除各连接线!软件进行操作中,切勿拔出各连接线!否则可能造成主机线路损坏。
用户名单
相关文献
1.Wei, Zhiliang et al.“ Toward accurate cerebral blood flow estimation in mice after accounting for anesthesia.”Frontiers in physiology vol. 141169622. 12 Apr. 2023, doi:10.3389/fphys.2023.11696222.Marchetti, Beatrice et al.“ Acute Cardiovascular and Cardiorespiratory Effects of JWH-018 in Awake and Freely Moving Mice: Mechanism of Action and Possible Antidotal Interventions?.” International journal of molecular sciences vol. 24,8 7515. 19 Apr. 2023, doi:10.3390/ijms24087515
3.Hashem, Mada et al.“ The relationship between cytochrome c oxidase, CBF and CMRO2 in mouse cortex: ANIRS-MRI study.” Journal of cerebral blood flow and metabolism : official journal of the International Society of Cerebral Blood Flow and Metabolism vol. 43,8 (2023): 1351-1364. doi:10.1177/0271678X231165842
4.Doyle, Michelle R et al.“ Strain and sex-related behavioral variability of oxycodone dependence in rats.”Neuropharmacology vol. 237 (2023): 109635. doi:10.1016/j.neuropharm.2023.109635
5.Fish, Brian L et al“. IPW-5371 mitigates the delayed effects of acute radiation exposure in WAG/RijCmcr rats when started 15 days after PBI with bone marrow sparing.” International journal of radiation biology vol. 99,7 (2023):1119-1129. doi:10.1080/09553002.2023.2173825
6.Liu, Yanqiu et al.“ Hypoxic White Matter Injury and Recovery After Reoxygenation in Adult Mice: MagneticResonance Imaging Findings and Histological Studies.” Cellular and molecular neurobiology vol. 43,5 (2023):2273-2288. doi:10.1007/s10571-022-01305-5
扩展阅读
关于MouseOx Plus在其他领域中的应用,推荐阅读以下文章,其详细介绍了该设备在神经科学研究中的应用文献。文章主要介绍了一篇通过该设备测量实验动物心率等参数评估实验动物的恐惧状态,同时详细介绍了该设备的功能与特点,为读者提供对该设备更全面的介绍。
关于玉研仪器在呼吸系统研究领域的应用,推荐阅读以下文章,其详细介绍了上海玉研科学仪器有限公司提供的造模、给药、评估设备在啮齿类动物肺纤维化研究中的全面解决方案。文章主要探讨了如何利用肺部液体雾化给药器、EMMSLink WBP动物呼吸生理检测分析系统、eSpira™用力肺功能检测系统等设备,为实验动物肺纤维化的造模方法、治疗手段、模型评估提供参考方案。

关于玉研仪器助力呼吸系统疾病研究,推荐阅读以下文章。该文章着重介绍了肺部液体雾化给药器等设备,在小鼠、大鼠等啮齿类动物模型的急性肺损伤、肺纤维化及慢性阻塞性肺疾病等研究中的关键作用。资料深入探讨了这些设备如何优化造模过程、改进给药技术,并为疾病模型的评估提供精确手段,为呼吸系统疾病的研究提供了有力的支持。

自研核心,铸就非凡实力
公司研发人员占比40%,拥有传感器、芯片设计、核心算法等科学家团队,在产品落地与运营,市场与学术推广,综合产品方案设计与应用等方面均有专业的团队提供支持,公司拥有可覆盖全国的服务点,技术服务能力强大,客户涵盖清华大学、北京大学、浙江大学、上海交通大学、中国科学院大学、四川大学华西医院、北部战区总医院等国内外一流研究机构、医院。





